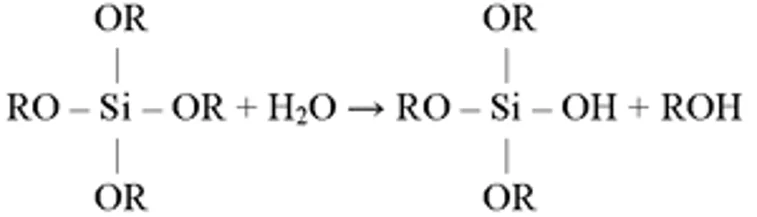
Zagadnienie modyfikacji powierzchni szkła poprzez nanoszenie bardzo cienkich powłok organiczno-nieorganicznych dotyczy wielu branż przemysłu szklarskiego (szkło opakowaniowe, gospodarcze oraz budowlane). W przypadku tego ostatniego chodzi o typy szkła płaskiego, stosowanego do szklenia różnych obiektów. W tych celach wykorzystuje się rodzaje szkła, w których warstwy powierzchniowe charakteryzują się zdolnością odbijania lub absorbowania promieniowania słonecznego (warstwy refleksyjne, niskoemisyjne), co pomaga łatwo zbilansować przepływ i wymianę energii pomiędzy otoczeniem i przeszklonym wnętrzem. Pierwowzorem takich powłok były i są powłoki w pełni nieorganiczne, nakładane na powierzchnie szkła metodą rozpylania katodowego z użyciem materiałów metalicznych lub metodą pirolizy – materiałów tlenkowych odpowiednich metali. Jednakże ten sposób poprawy właściwości funkcjonalnych szkieł budowlanych jest dość trudny preparatywnie i kosztowny ze względu na stosowanie bardzo wysokich temperatur. Ponadto nie zapewnia wymaganych, w określonych warunkach eksploatacyjnych, cech i właściwości. Chodzi w tym przypadku o takie cechy, jak: określona barwa, odporność chemiczna, odporność na zarysowania itp. Ten, o wiele szerszy zakres właściwości szkieł zwłaszcza płaskich, zapewnia metoda organiczno-nieorganiczna (hybrydowa), chemiczna typu zol-żel.
Podstawy chemiczne zastosowania metody hybrydowej
Szkło jako tworzywo nieorganiczne składające się z szeregu tlenków metali (Na2O, CaO, SiO2, B2O3, PbO, Al2O3 itp.), otrzymywane w wyniku stapiania wysokotemperaturowego (~1200˚C), odznacza się dużą odpornością chemiczną. Jednak, ze względu na różne warunki jego pracy (szkło budowlane, laboratoryjne, optyczne itp.), posiada również różny skład chemiczny. Na przykład szkło laboratoryjne (jenajskie) jest wzbogacone w trójtlenek boru (B2O3), optyczne w tlenek ołowiu (PbO), a szkło budowlane – w tlenki wapnia i sodu (CaO i Na2O). Oczywiście, podstawowym składnikiem wszystkich rodzajów szkieł jest piasek kwarcowy (SiO2).
Już z powyższej, bardzo pobieżnej analizy składu wybranych rodzajów szkła wynika, że szkło budowlane zawiera w swoim składzie znaczącą ilość pierwiastków alkalicznych i ziem rzadkich (Na, Ca), co w głównej mierze decyduje o jego zachowaniu chemicznym.
Uważa się, że woda czysta działa na szkło, co niektórzy badacze tłumacza dużą koncentracją jonów alkalicznych, podatnych na hydratację i tworzenie roztworów ługu oddziaływujących na szkło. Występuje również reakcja hydrolizy krzemianów, powstałych w procesie wytopu szkła w postaci Na2SiO2 x CaSiO2 x SiO2, powodująca pokrycie powierzchni szkła warstwą żelu krzemionkowego. Tworzy się w ten sposób pewnego rodzaju warstwa ochronna szkła przed dalszym wyługiwaniem (rozkładem), które jednak dalej postępuje z szybkością zależną od szybkości dyfuzji (przenikania) wody i produktów reakcji przez tę warstwę. W szkłach boranowych i fosforanowych tego rodzaju warstwa nie powstaje, stąd też szybkość rozkładu zależy od szybkości uwodnienia.
Wbrew pozorom, odporność np. szkieł gospodarczych na działanie kwasów jest dużo większa niż na działanie wody, z wyjątkiem kwasu fluorowodorowego (rozkłada szkło na zimno) i kwasu fosforowego (rozkłada szkło już w temperaturze 100˚C). Odporność na działanie kwasów wzrasta w szkłach przy zwiększaniu dodatku SiO2, Al2O3 (do 25%), ZrO2 i TiO2 w składzie szkła. Szkła ołowiane są dość wrażliwe na działanie kwasów. Odporność szkieł gospodarczych na działanie ługu jest, co najmniej 100 razy mniejsza niż na działanie kwasów. Powodem tego jest rozpuszczanie żelu krzemionkowego z powierzchni szkła i przejście do roztworu koloidalnego. Odporność szkieł na działanie ługów wzrasta ze zwiększeniem dodatku ZrO2, BeO, SiO2, CaO w zestawie szkła, a zmniejsza się na skutek większych zawartości BaO, MgO i TiO2.
Przedstawione powyżej dane odnośnie degradacji (ługowania) powierzchni szkła, są swego rodzaju przykładem zjawisk i procesów chemicznych oraz fizycznego-chemicznych, zachodzących w szkłach, jako materiałach nieorganicznych, pod wpływem kwasów, ługów, a przede wszystkim wody.
Uzyskane w tym względzie doświadczenia wskazują, że środowisko wodne w kontakcie z powierzchnią szklaną, wywołuje chemiczne procesy hydratacji i hydrolizy i fizyczno-chemiczne tworzenia układów koloidalnych krzemionki typu zolo-żelu.
Skuteczność naruszania struktury powierzchniowej szkła jako wyrobu hutniczego, powstającego w bardzo wysokich temperaturach, zachęciło badaczy do dalszych poszukiwań takich rozwiązań technologicznych, które pozwolą modyfikować powierzchnię szkła w sposób chemiczny, bez uciekania się do metod wysokotemperaturowych wtapiania w szkło bazowe powłok nieorganicznych, np. typu SiO2 – TiO2 | TiO2 | SiO2.
Do nowych, nie stosowanych do tej pory technologii zachęcił postęp nauk chemicznych w ogóle a chemii IV grupy układu okresowego pierwiastków w szczególności.
Twórczym impulsem w tym zakresie okazał się rozwój chemii polimerów na bazie pierwiastka krzemu (żywice silikonowe) i występowania w nich obok krzemu drugiego pierwiastka tej grupy – węgla. Bardzo pomocnymi w rozwoju nowych technologii okazało się również wykrycie jeszcze innych właściwości tych dwóch, bezpośrednio sąsiadujących pierwiastków: węgla stanowiącego budulec związków organicznych (węglowodorów), np. CH4 (metan) i krzemu będącego fundamentem szeregu minerałów z powtarzalnym segmentem strukturalnym o wzorze SiO4.
Potwierdzeniem trwałości tego typu połączeń tych pierwiastków, są występujące w naturze węglowodory ropy naftowej i materiały krzemianowe typu piasku kwarcowego i skał z udziałem kwarcu (kwarcyty, piaskowce, granity, sjenity i inne).
Kolejnymi przesłankami sugerującymi możliwości wiązań chemicznych między połączeniami węgla i krzemu były:
- występowanie w silikonach (polimerach) wiązań typu Si – C,
- identyczność liczb elektronów walencyjnych (wartościowości) tych dwóch pierwiastków: C – 2s22p2 i Si – 3s23p2,
- zdolność do tworzenia związków typu łańcuchowego w tych dwóch pierwiastkach:
C – C – C ..., Si – Si – Si ...; przy czym tendencja ta występuje mniej wyraźnie w krzemie, - zarówno węgiel jak krzem, zarówno między sobą jak innymi pierwiastkami tworzą wiązania kowalencyjne i kowalencyjno-spolaryzowane.
Poza podobieństwami między związkami węgla z wodorem i krzemu z tlenem, są również różnice. Węglowodory w wysokich temperaturach ulegają spaleniu, to połączenia krzemowe – stopieniu. W wyniku powolnego ochładzania stopionego SiO2 (w szkle i skałach SiO4) powstaje substancja bezpostaciowa (amorficzna), która ma wygląd szklisty i jest szkłem w sensie ogólnym, czyli materiałem nie wykazującym uporządkowania dalekiego zasięgu, lecz stanowiącym bezładny zbiór polimerycznych łańcuchów, warstw lub jednostek trójwymiarowych. pod względem struktury chemicznej związek SiO4 zbliża się do wiązania kowalencyjno-jonowego na tej zasadzie, że elektrony wartościowości Si są przyciągane przez tlen w postaci jonów: Si++++ i O--. Naładowany dodatnio względem tlenu Si++++ (Si4+) stara się ściągnąć do siebie ujemnie naładowane O--(O2-) niezależnie od ich liczby. Jednakże stosunek promieni krzemu i tlenu przy uwzględnieniu zdolności polaryzacyjnych warunkuje całkowicie przesłonięcie Si4+ przy otoczeniu go czterema tlenami, co wyznacza też liczbę koordynacyjną– cztery. W związku z tym komórka elementarna SiO4 zbudowana jest z czworościanu, w którego środku znajduje się krzem, a cały utwór strukturalny (powierzchnia zewnętrzna) naładowana jest ujemnie. Stąd, w celu zachowania równowagi elektrostatycznej i stabilności układu wprowadza się tlenki metali alkalicznych (Na2O, CaO).
Jak wcześniej zauważono, taki zabieg technologiczny skutkuje tym, że szkło sodowo-wapniowe staje się w pewnych warunkach tworzywem wrażliwym na wodę. Końcowym efektem takich oddziaływań jest powstawanie żelu krzemionkowego na powierzchni szkła, ale jego jakość nie spełnia funkcji ochronnych.
Stąd poszukiwania korzystniejszych rozwiązań w tym zakresie.
1.1. Istota technologii zabezpieczania powierzchni szkła kopolimerami silikonowymi
Głównym powodem zastosowania metody zol-żel z użyciem kopolimerów silikonowych jest możliwość sterowania składem chemicznym i własnościami takich powłok w znacznie szerszym zakresie, niż to ma miejsce przy nanoszeniu na powierzchnię szklistych warstw metodą hutniczą. Duże znaczenie odgrywa w tym przypadku zdecydowane obniżenie temperatury procesu poniżej 300˚C.
W technologii tej stosuje się zazwyczaj alkoholany krzemu, które mają wchodzić w skład i nadawać mu odpowiednie właściwości. Nie ma w tym przypadku potrzeby wprowadzania do syntezy związków, spełniających rolę topników, środków klarujących, czy innych surowców pomocniczych, używanych w procesie hutniczym, ponieważ cały proces oparty jest na zupełnie innych zasadach. Zasadniczymi reakcjami, zachodzącymi podczas syntezy zol-żel są reakcje hydrolizy alkoholanów i jednoczesnej polikondensacji, prowadzącej do utworzenia sieci tlenkowej (zasadniczy szkielet) i rodników węglowodorowych, w łańcuchach bocznych.
Przy otrzymywaniu szkła krzemionkowego metodą zol-żel składniki roztworu podstawowego zawierają:
- tetraetoxysilan Si(OC2H5)4 lub tetrametoxysilan Si(OCH3)4;
- rozpuszczalnik w postaci alkoholu etylowego lub metylowego;
- woda w ilości kontrolowanej;
- HCl (kwas solny) jako katalizator reakcji hydrolizy.
Po zamieszaniu wyżej wymienionych składników zachodzą następujące reakcje:
hydrolizy
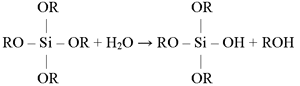
polikondensacja
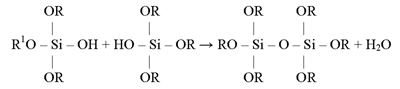
Powyższej reakcji towarzyszy przemiana roztworu zol w żel o wymaganych, wcześniej zaprogramowanych, właściwościach, tj. lepkość, elastyczności, rozszerzalności cieplnej.
Właściwości fizyczne a zwłaszcza lepkość błonki jest pochodną wielkości makromolekuły kondensatu, która z kolei zależy od intensywności reakcji hydrolizy i polikondensacji.
W przypadku ostrzejszych warunków hydrolizy, więcej grup etoksylowych (-O-C2H5) bądź metoksylowych (-O-CH3) w molekule ulega przemianie na grupy wodorotlenowe (-OH) i w ten sposób, w procesie polikondensacji powstają większe makromolekuły, warunkujące wzrost lepkości błonki.
W ostatnim okresie kilkunastu lat metoda zol-żel została wykorzystana w warunkach przemysłowych, do wykonawstwa, np. warstw barwnych, refleksyjnych i antyrefleksyjnych.
Efekty barwne uzyskuje się na przykład poprzez rozproszenie w żelu krzemionkowym koloidalnej zawiesiny nanocząsteczek metali, takich jak złoto (Au) i srebro (Ag).
Barwne powłoki wytwarza się w taki sposób, że związki tych metali (AuHCl4) i (AgNO3) rozpuszcza się w prekursorach krzemionki, tzn. tetraetoxysilanie lub tetrametoxysilanie w obecności różnych reduktorów, np. formaldehydu.
Poddane redukcji jony dodatnie złota (Au+) i srebra (Ag+), tworząc w polikondensacie stan rozproszenia (układ koloidalny), wykazują określone właściwości barwne.
Poza metalami szlachetnymi, w roli barwników mogą występować określone połączenia organiczne, które z żelem krzemionkowym wiążą się głównie na zasadzie wiązań kowalencyjnych krzem-węgiel.
2. Wnioski końcowe
-
Modyfikacja powierzchni szkła różnymi metodami stanowi aktualnie jeden z najpopularniejszych sposobów poprawy właściwości wyrobów szklanych oraz rozszerzenia ich zastosowania na różne dziedziny przemysłu i życia codziennego;
-
Z dwóch głównych technologii modyfikacji szkła (metoda wysokotemperaturowa – hutnicza i zol-żel), większe możliwości rozwoju posiada ta ostatnia, w związku z propozycją znacznego obniżenia temperatury procesu;
-
Nawet pobieżna analiza treści artykułu pozwala dojść do wniosku, że istotę przedstawionej technologii zol-żel jest wynalezieniem sposobu związania warstwy organicznej z podłożem nieorganicznym, według mechanizmu wiązań chemicznych, bez konieczności stosowania bardzo wysokich temperatur.
Prof. dr hab. inż. Bogusław Stefańczyk
Zachodniopomorski Uniwersytet Technologiczny
Literatura:
[1] Łączka M., Terczyńska A., Cholewicka-Kowalska K.: Powłoki żelowe na szkle nr 1. „Świat Szkła” 9/08/2008
[2] Łączka M., Terczyńska A., Cholewicka-Kowalska K.: Powłoki żelowe na szkle nr 2 „Świat Szkła” 11/08/2008
[3] Cotton F.A., Wilkinson G., Paul L.G.: Chemia nieorganiczna, Wydawnictwo Naukowe PWN, Warszawa 1998
[4] Saechtling: Tworzywa sztuczne. Wydawnictwo Naukowo-Techniczne „poradnik”, Warszawa 1998
[5] Szlezyngier W.: Tworzywa sztuczne t I. Wydawnictwo Oświatowe FOSZE, Rzeszów 1998





1.webp)


.webp)

